Содержание статьи:
Современные ученые смотрят на препараты бактериофагов как на более эффективную (в определенных случаях) альтернативу антибиотикам. Однако фаги можно использовать не только вместо, но и вместе с антибактериальными препаратами. Они вполне совместимы и, мало того, при одновременном применении наблюдается их синергия: они усиливают друг друга. Итоговый эффект получается намного лучше, чем сумма эффектов фагов и антибиотиков. Кроме того, такая комбинированная терапия активирует врожденные иммунные механизмы, и те тоже начинают бороться против болезнетворных бактерий.
Преимущества комбинированного лечения
Помимо синергии и взаимного усиления, существуют и другие причины, по которым стоит использовать бактериофаги вместе с антибиотиками:
- В ряде случаев снижается необходимая доза антибактериального препарата. Можно вводить меньше лекарства, а эффект получать тот же или даже сильнее. Проблема антибиотикорезистентности изначально возникала из-за того, что бактерии эволюционируют и постепенно приспосабливаются к препаратам. И эта эволюция происходит тем скорее, чем чаще люди используют антибиотики, особенно бесконтрольно, чем большие дозы принимают. Так что фаги могут замедлить нарастание устойчивости бактерий к антибиотикам и даже восстановить чувствительность – вызвать ресенсибилизацию.
- Устойчивость микроорганизмов к бактериофагам и антибактериальным препаратам зачастую работает как две чаши весов. Дело в том, что гены, обеспечивающие невосприимчивость к тем или иным лекарствам – приобретение не «бесплатное». Геном бактерий довольно мал и, добавляя в него что-то одно, часто приходится избавляться от другого. Поэтому возбудители, которые становятся устойчивыми к бактериофагам, нередко одновременно теряют устойчивость к антибиотикам.
- Идеального лечения всё равно не существует. Хотя о бактериофагах сейчас можно найти массу хвалебных статей, они не всесильны. В то же время антибиотикорезистентность пока еще не откатила нас во времена до пенициллина. Антибактериальная терапия зачастую все еще работает, и будет работать, если ее грамотно применять. Поэтому стоит использовать обе группы препаратов, чтобы компенсировать слабые стороны одних сильными других.
- Фаги хорошо сочетаются не только с антибиотиками. Их можно использоваться вместе с пробиотиками (препаратами, содержащими полезные микроорганизмы) и пребиотиками (питательными веществами, необходимыми для роста нормальной микрофлоры). Это полезно, например, для восстановления нормальной микробиоты кишечника, если после курса антибиотикотерапии развился дисбиоз.
Как антибиотики и фаги усиливают друг друга?
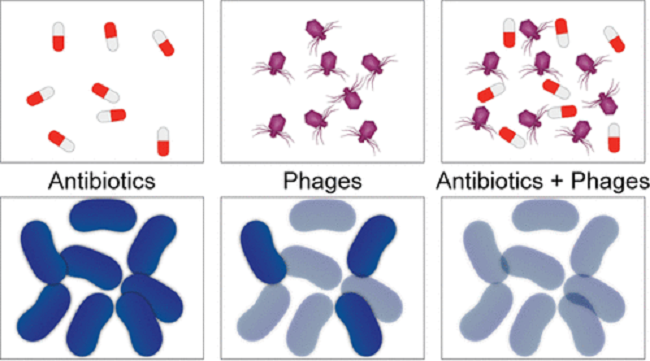
Синергетические эффекты комбинаций фагов и антибиотиков против Citrobacter amalonaticus © pubs.acs.org
Ученые называют семь основных способов синергии между антибиотиками и бактериофагами:
- Антибиотики ускоряют распространение инфекции, вызванной фагами. Новые бактерии заражаются быстрее.
- Антибиотики способствуют тому, что бактериофаги легче и успешнее уничтожают микроорганизмы.
- В свою очередь, фаги повышают чувствительность бактерий к антибиотикам.
- При комбинированной терапии появляется меньше бактерий, толерантных к фагам или антибиотикам.
- При добавлении фагов нужны более низкие концентрации антибиотиков, чтобы остановить рост бактерий.
- Ферменты бактериофагов растворяют вещества, вырабатываемые микроорганизмами, и облегчают проникновение антибиотика в клетку.
- Антибиотики могут активировать фаг, который «спит» внутри бактериальной клетки.
Поговорим о каждом из этих механизмов поподробнее.
Ускорение распространения фаговой инфекции под действием антибиотиков
Этот эффект проверить довольно легко. Если посеять бактерии в чашке Петри и добавить к ним соответствующие фаги, то спустя некоторое время на культурах появятся полупрозрачные бляшки: это те места, где вирусы уничтожили микроорганизмы. Зачастую, если добавить еще и антибиотик, бляшки начинают расти быстрее. То же происходит и в организме человека во время лечения.
Чтобы добиться такой синергии, нужно знать, какие препараты сочетать. Например, антибиотики линезолид и тетрациклин ускоряют рост бляшек на культурах с золотистым стафилококком, зараженным вирусом, в три раза. А пенициллины и цефалоспорины такого влияния не оказывают. Цефотаксим в экспериментах приводил к тому, что из зараженных стафилококков выходило в десятки раз больше новых фагов T4, чем обычно.
Более эффективное разрушение бактерий фагами при добавлении антибиотиков
Некоторые антибиотики, например, бета-лактамы и хинолоны, заставляют бактерии вести себя очень странно. Микроорганизм постоянно удлиняется, он как бы хочет поделиться на две дочерние клетки, но не делится. Одновременно в бактериальной клетке возникают биохимические нарушения, и все это делает ее более уязвимой к ферментам фага. А когда после заражения внутри синтезируются новые вирусные частицы, им проще разрушить своего хозяина и выйти наружу.
Повышение чувствительности к антибиотикам под действием фагов
Явление, когда микроорганизмы вновь становятся чувствительными к антибактериальному препарату, называется ресенсибилизацией. Фаги могут вызывать такой эффект – в частности, ученые наблюдали его во время экспериментов с синегнойными палочками. После заражения вирусами чувствительность этих возбудителей к антибактериальным препаратам повышалась на 63–81%. Исследователи считают, что это прямое следствие того, что бактерии приобрели устойчивость к фагам – из-за этого ослаб «щит» в другом месте.
Уменьшение числа устойчивых микроорганизмов
Тут два препарата, можно сказать, прикрывают друг другу спину: бактериофаги разрушают бактерии, чувствительные к антибиотикам, а антибиотики – к фагам. Например, одно исследование показало, что при некоторых инфекциях сочетание меропенема и ципрофлоксацина полностью предотвращает появление мутантов, резистентных к бактериофагам.
Такой подход неплохо работает даже против знаменитых «супербактерий» – метициллин-резистентных золотистых стафилококков (MRSA). Исследования показали, что антибиотики даптомицин и ванкомицин в сочетании с бактериофагами намного эффективнее убивают MRSA, чем по отдельности. При этом антибактериальные препараты помогли предотвратить возникновение резистентности к фагам.
Снижение минимальной ингибирующей концентрации
Если применять антибактериальные препараты вместе с бактериофагами, то снижается их минимальная концентрация, необходимая для подавления микроорганизмов. Это открытие было сделано учеными совсем недавно – только в 2007 году.
Эффекты ферментов бактериофагов

Бактериофаги обладают ферментами-деполимеразами, некоторые из которых входят в состав фаговой частицы и нужны для проникновения в бактериальную клетку, а другие образуются в самом микроорганизме после инфицирования, чтобы его разрушить. Это уже само по себе помогает бороться с инфекцией, но к тому же облегчает работу антибиотикам:
- Одни деполимеразы повреждают саму бактерию, ее стенку, и в итоге в нее легче проникают антибактериальные препараты.
- Другие растворяют соединения, которые входят в состав биопленок. В определенных условиях бактерии, прикрепляясь к поверхности, склеиваются друг с другом и синтезируют слизь. Получается колония микроорганизмов, как бы погруженная в желе. Это и есть биопленка, своего рода «крепость», в которой микроорганизмы «прячутся» от неблагоприятных внешних факторов. Таким образом они защищаются и от бактериофагов, но эта защита работает далеко не всегда. Ведь фаги и сами эволюционируют, учатся «вскрывать» эти «бактериальные бункеры» с помощью ферментов. Они, как опытные штурмовики, прокладывают дорогу, а антибиотики устремляются следом.
Эти соображения доказаны в реальных экспериментах. Например, если добавить в культуру синегнойных палочек альгинатлиазу – фермент, вырабатываемый бактериофагами, – то антибиотики из группы аминогликозидов лучше подавляют рост микроорганизмов.
Активация «спящих» в бактериях фагов
В других статьях на нашем сайте мы рассказывали, что фаг может взаимодействовать с бактерией двумя основными способами. Повторим в общих чертах суть этих механизмов:
- Литический путь – когда фаг запускает в тело клетки свою ДНК, она интегрируется в бактериальный геном и сразу превращает микроорганизм в завод по выпуску целой армии новых вирусов. В конце концов микроорганизм погибает, разрушается, а новые фаги выходят наружу.
- Лизогенный путь – когда фаговая ДНК встраивается в клетку микроорганизма, но дальше становится неактивной. Это так называемый профаг, и он может «спать» очень долго. Но однажды он активируется, и запускается литический путь. Эта активация называется индукцией профага и может запускаться спонтанно (сама по себе случайным образом) или под влиянием каких-нибудь факторов, например, ультрафиолетового излучения.
Некоторые антибиотики способны активировать литический цикл. Например, таким эффектом обладают фторхинолоны. Таким образом, сам по себе умеренный фаг не причиняет бактериям особого вреда, а в присутствии антибактериальных препаратов превращается в безжалостного убийцу.
Есть ли доказательства на конкретных пациентах?

Стефани Стратди и ее муж Томас Паттерсон. На его фотографии изображена супербактерия, которая чуть не убила его; ее фаг, который спас ему жизнь. Фотография предоставлена Стефани Стратди | UC San Diego Health | www.theguardian.com
Главная проблема с вышеописанными эффектами синергии между антибиотиками и фагами в том, что они проверены по большей части в экспериментах «в пробирке». Но в «диких» условиях и тем более в организме человека всё намного сложнее. По лабораторным опытам нельзя точно сказать, сработает ли сочетание препаратов так же эффективно, и поможет ли это лучше справиться с инфекцией.Такие выводы можно делать только после клинических исследований с участием реальных больных. И подобные работы тоже проводились.
Один клинический случай оказался настолько ярким, что в Америке по нему написали документальную книгу. В 2017 врачам удалось с помощью антибиотиков и фагов излечить 68-летнего мужчину с некротизирующим панкреатитом (тяжелым воспалением поджелудочной железы), вызванным антибиотикорезистентной бактерией.
Всё началось в 2015 году, когда психолог Том Паттерсон отдыхал в Египте. Там мужчина заболел какой-то кишечной инфекцией. К счастью, его супруга Стефани Стратди имела отношение к медицине – она работала эпидемиологом. Женщина сразу «прописала» мужу антибиотик и была уверена, что скоро болезнь пройдет. Но Тому становилось только хуже. Местные врачи лишь разводили руками: они ничем не могли помочь.
Когда стало понятно, что всё очень серьезно, супруги обратились в одну из передовых клиник Сан-Диего. Вердикт врачей был неутешителен: у Тома обнаружили бактерию Acinetobacter baumannii, а именно ее штамм, устойчивый сразу ко многим антибиотикам. Тем временем мужчина впал в кому.
Как и всякий не привыкший сдаваться человек «западного» образца, Стефани начала собственное расследование в поисках способов помочь супругу. Она узнала, что против тяжелых инфекций могут помочь вирусы бактерий – бактериофаги. Женщина задействовала все свои связи в научных кругах, чтобы получить фаги, инфицирующие тот самый штамм Acinetobacter baumannii. Наконец, на фоне лечения антибиотиком моноциклином мужчине стали вводить внутривенно бактериофагопрепарат. И пациент пошел на поправку.
С тех пор супружеская пара занялась активным продвижением фаготерапии.
Могут ли антибиотики и фаги мешать друг другу?

У синергии между антибиотиками и фагами есть и обратная сторона – иногда эти препараты работают как антагонисты. Этот вопрос исследован очень мало, но всё же есть некоторые лабораторные наблюдения и гипотезы.
Вот пара примеров антагонизма, которые заметили ученые во время экспериментов:
- Когда культуру золотистых стафилококков обрабатывали одновременно фагами и антибиотиками ванкомицином или гентамицином, то они подавляли рост бактерий хуже, чем по отдельности.
- Фаги и антибиотик тобрамицин мешают друг другу бороться с синегнойными палочками.
Одна из возможных причин такого антагонизма в том, что антибиотики, вероятно, способны сокращать численность микроорганизмов настолько, что фагам становится сложно их заражать. Ведь бактериофаги – разрушители не совсем обычные, они не умеют бегать за жертвами. Чем ниже концентрация бактерий, тем ниже и вероятность того, что они встретятся с частицей вируса.
Вторая гипотеза гласит, что антибиотики могут нарушать в бактериальных клетках процессы, необходимые для жизненного цикла фага.
Итак, взаимодействия между бактериофагами и антибактериальными препаратами сложны и не до конца изучены. Нужны новые исследования, чтобы разобраться, какие препараты и в каких случаях стоит сочетать, в каких дозах, как их вводить. Это даст врачам новый эффективный инструмент для борьбы с опасными инфекциями и поможет хотя бы отчасти решить проблему антибиотикорезистентности.
Бактериофаги, пожиратели бактерий и конец эры антибиотиков

Список литературы и библиографических ссылок:
- ncbi.nlm.nih.gov – Комбинированная терапия фагами и антибиотиками: два лучше, чем один
- ncbi.nlm.nih.gov – Комбинированное лечение фагами и антибиотиками: антагонистическое влияние антибиотиков на фармакодинамику фаговой терапии?
- jbiomedsci.biomedcentral.com – Взаимодействие бактериофагов и антибиотиков в клинической практике: что мы знаем на сегодняшний день