Содержание статьи:
В современном мире главные убийцы людей – сердечно-сосудистые заболевания и злокачественные опухоли. Но когда-то ситуация была совсем иной. Первое место среди угроз для здоровья и жизни стабильно занимали инфекции. Даже просто порез мог осложниться «заражением крови» и убить, не говоря уже о ранах, в которых попадала земля – на войне или в сельской местности. Население всех стран повально выкашивал туберкулез. Роды были очень опасны – зачастую от инфекционных осложнений погибали и мать, и ребенок.
Спасение пришло в первой половине прошлого столетия, когда знаменитый британский микробиолог Александр Флеминг открыл пенициллин. В ситуациях, когда раньше человека ждала неминуемая смерть, сегодня зачастую достаточно посетить врача, который назначит подходящий антибиотик.

Однако, сейчас угроза возвращается. Бактерии эволюционируют и становятся устойчивыми ко многим антибактериальным препаратам, а создавать новые антибиотики становится всё сложнее. Эксперты из Всемирной Организации Здравоохранения уже не первый год бьют тревогу по поводу проблемы антибиотикорезистентности.
Ученые всего мира вынуждены искать новые решения этой проблемы. И многие осознают, что пора бы вспомнить хорошо забытое старое. Намного раньше антибиотиков были открыты особые вирусы, которые заражают только бактериальные клетки – бактериофаги. И очень быстро выяснилось, что с помощью них можно бороться с опасными бактериальными инфекциями – появилось направление бактериофаготерапии, или фаготерапии. С открытием антибиотиков о нем быстро подзабыли. Но теперь интерес к нему снова просыпается.
Бактериофаги – кто это такие?
Бактериофаг – тот же вирус, но поражает он только бактериальные клетки. На каждую бактерию есть своя разновидность таких хищников. Эти вирусы – самые древние среди всех своих сородичей, и, к слову, это самые многочисленные существа на планете Земля. Например, в водопроводной воде их содержится примерно 2х108/мл. Это в десять раз больше, чем бактерий.
Разновидностей бактериофагов существует огромное множество. Ученые даже не уверены, являются ли все они родственниками с одним общим предком или произошли от разных вирусов. Поэтому и классификация фагов сложна, и ученые пересматривают ее чуть ли не несколько раз за год. К тому же, есть подозрение, что науке известна лишь малая часть всех существующих видов бактериофагов, а хорошо изучено и того меньше.
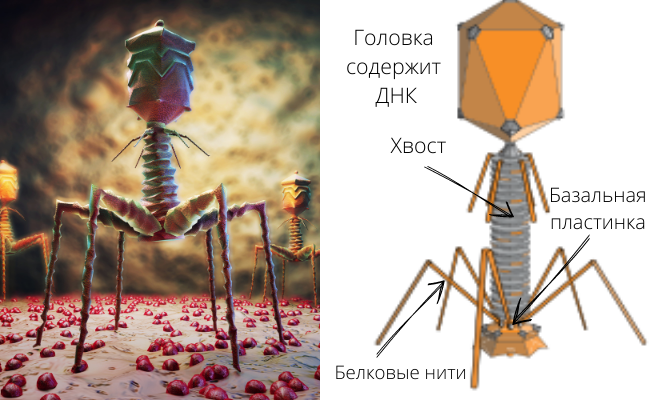
Внешность фагов тоже сильно различается. В большинстве представлены так называемые хвостатые фаги. Их строение схематически представлено на рисунке вы видите фаг лямбда, паразитирующего на Escherichia coli (кишечная палочка). Строение его элементарно: внутри находится генетический материал в виде ДНК, снаружи он окружен оболочкой из белков (нуклеокапсид). От «головки» вируса отходит хвост – с помощью него он и прикрепляется к оболочке клетки, после чего вводит внутрь генетический материал. Далее вирусная ДНК внедряется в хромосому бактериальной клетки и заставляет ее производить новые фаговые частицы. Интересно отметить, что, в отличие от других хищников, фаги не умеют преследовать своих жертв. Они просто пассивно ждут удачного момента, когда удастся столкнуться с бактериальной клеткой – и тут уж не упускают своего шанса.

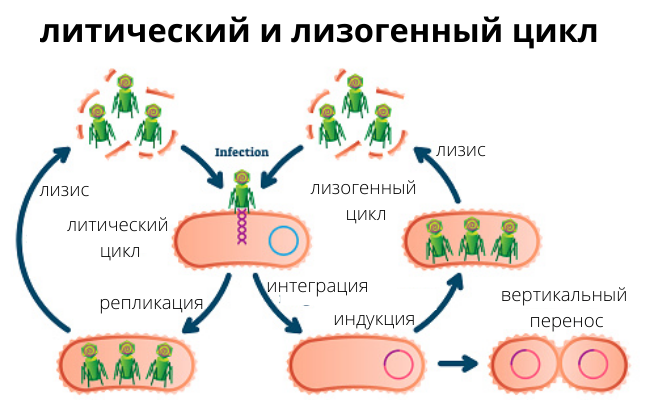
Взаимодействия между вирусами и соответствующими им бактериальными клетками довольно многогранны и интересны. Уже после того, как вирус запускает свою ДНК внутрь бактерии, события могут развиваться по одному из двух путей, и в зависимости от этого фаги делят на два основных типа:
- Вирулентные фаги наиболее агрессивны. Их ДНК, попавшая в бактерию, сразу заставляет ее синтезировать множество новых вирусных частиц, и они буквально разрывают жертву изнутри. Оказавшись на свободе, новые фаги отправляются на поиски очередных жертв. Такой тип взаимодействий называется литическим циклом.
- Умеренные фаги действуют как опытные диверсанты. Когда фаговая ДНК встраившись в хромосому, не спешит превращать клетку в конвейер по выработке новых фаговых частиц, а вместо этого может долгое время находиться в пасивном состоянии, в виде так называемого профага. Но потом может в любой момент активироваться – спонтанно или под действием каких-либо факторов (например, ультрафиолетового излучения) – и запустить литический цикл.
Впрочем, отношения между фагами и бактериями не ограничиваются чисто хищническими. В природе бактериофаги помогают контролировать численность бактериальных популяций и иногда даже наделяют своих хозяев новыми полезными свойствами. Современные ученые убедились: любые вирусы – это не просто возбудители инфекций. В масштабе всей планеты они представляют глобальную систему переноса генетической информации.
Немного истории

Считается, что впервые с бактериофагами познакомился в 1896 году британский бактериолог Эрнест Ганкин. Он обнаружил, что вода из индийских рек Ганг и Джамна обладает антибактериальными свойствами в отношении возбудителя холеры – холерного вибриона. Причем вода сохраняла свои чудесные свойства, даже будучи пропущенной через фильтры, которые не мог преодолеть ни один известный на то время микроорганизм. О вирусах в те времена никто не знал, поэтому ученый предположил, что в воде есть какие-то химические соединения, которые убивают бактерии. Были ли это фаги? Очень похоже, хотя и нельзя утверждать со стопроцентной вероятностью.
Спустя два года аналогичный эффект наблюдал русский врач, бактериолог и эпидемиолог Николай Фёдорович Гамалея, когда изучал бактерии Bacillus subtilis. Он даже выделил субстанцию с антибактериальными свойствами и назвал ее «литическим ферментом».

Настоящим первооткрывателем бактериофагов можно считать британского исследователя Фредерика Туорта, а помогла ему в этом счастливая случайность (кстати, как и Александру Флемингу с пенициллином). В начале прошлого столетия вирусы уже были известны, но никто не представлял себе толком, что это такое. Туорт считал, что их можно выращивать на бесклеточных средах и решил подобрать такую подходящую среду в чашках Петри для вируса осповакцины. Но вакцина для экспериментов оказалась не совсем чистой: она была контаминирована стафилококками. Они и выросли в чашке. Но ученый заметил нечто необычное: некоторые колонии бактерий получились полупрозрачными. Самих стафилококков в них не оказалось, но обнаружились остатки уничтоженных микроорганизмов. Туорт предположил, что бактерии убил некий вирус.

Наконец, второе и окончательное открытие фагов произошло в 1916 году во Франции. В те времена исследователь Феликс д’Эрелль исследовал вспышку дизентерии в одном из эскадронов драгунского полка, стоявшем под Парижем. Он считал, что эту болезнь вместе с бактерией вызывает какой-то вирус, и два возбудителя действуют сообща. д’Эрелль пропустил фекалии больных через фильтр, который не пропускал бактерии, и обнаружил, что полученный фильтрат способен уничтожать другие микроорганизмы. Когда он высевал в чашке культуры бактерий, а потом добавлял к ним фильтрат кала выздоравливающих больных, то на колониях появлялись те самые полупрозрачные бляшки, которые когда-то были замечены Туортом. д’Эрелль сразу же понял, что открыл новые «вирусы бактерий» и придумал вместе с супругой для них название – «бактериофаги». д’Эрелль и стал пионером в применении фаготерапии.

Позже бактериофаготерапией сильно заинтересовались в Советском Союзе. В Тбилиси «пожирателей бактерий» изучали в специально для этого организованном в 1923 году НИИ микробиологии, вирусологии и иммунологии, туда приезжал сам д’Эрелль. Затем бактериофаги в СССР изучала легендарная Зинаида Виссарионовна Ермольева – создательница первых советских антибиотиков. Когда во время Великой Отечественной войны в Сталинграде началась эпидемия холеры, Зинаида Виссарионовна прибыла в очаг, стала бороться с распространением инфекции, и во многом в этом помогли холерные бактериофаги. Вообще, в области фаготерапии СССР добился немалых успехов. Но фаги не выдержали конкуренции с антибиотиками.

При каких заболеваниях применяют бактериофаги?
На каждую бактерию существует свой фаг, и теоретически возможности для их применения безграничны. Нужно лишь найти подходящего «хищника», способного уничтожать возбудителей инфекции. Это в теории, а на практике всё немного сложнее (об ограничениях фаготерапии еще поговорим ниже). Тем не менее препараты бактериофагов уже находят применение при многих заболеваниях:
- Болезни ЛОР-органов (уха, горла, носа), бронхов и легких: синуситы, средний отит, фарингит, ангина, ларингит, трахеит, бронхит, плеврит, пневмония. Препараты для фаготерапии очень любят и широко используют многие ЛОР-врачи.
- Хирургические инфекции. Бактериофаги эффективны при большинстве гнойных процессов: абсцессах, флегмонах, нагноившихся ранах, инфекционных осложнениях при ожогах, гидрадените, карбункулах, фурункулах, панариции. Применяют их при гнойных процессах в молочной железе (мастит), тканях вокруг прямой кишки (парапроктит), суставных сумках (бурсит), костях (остеомиелит).
- Инфекции органов мочеполовой системы: воспаление мочеиспускательного канала (уретрит), мочевого пузыря (цистит), почечных лоханок (пиелонефрит), шейки матки (кольпит), слизистой оболочки матки (эндометрит), маточных труб и яичников (сальпингоофорит).
- Заболевания в офтальмологии: некоторые воспалительные процессы в роговице (кератит), в том числе с язвами, конъюнктивиты, иридоциклиты.
- Болезни органов пищеварения: кишечные инфекции, диарея, дисбактериоз, холецистит.
- Сепсис – генерализованная инфекция, когда в ответ на внедрение болезнетворных микроорганизмов развивается системный воспалительный ответ, захватывающий все органы.
- Другие инфекции, вызванные бактериями, чувствительными к бактериофагам, которые находятся в том или ином препарате.

Применяют фаготерапию и для профилактики: раствором обрабатывают свежие и послеоперационные раны, дают его пациентам при высоком риске внутрибольничной инфекции (ведь бактерии, циркулирующие в клиниках, зачастую уже выработали устойчивость к антибиотикам).
Чаще всего препараты бактериофагов выпускают в виде растворов во флаконах. Применять их можно разными способами:
- Внутрь – то есть проглатывать.
- Промывать раны, делать примочки.
- Вводить турунды и тампоны, смоченные раствором, например, в носовую полость, влагалище.
- Закапывать в нос, глаза, уши.
- Полоскать рот, горло.
- Вдыхать в виде ингаляций. Но использовать можно только компрессорные ингаляторы (небулайзеры), где аэрозоль создается за счет сжатого воздуха. В ультразвуковых ингаляторах бактериофаги разрушаются.
- Вводить в различные органы и полости, например, в матку, мочевой пузырь, брюшную, плевральную полость.
- При системных инфекциях есть опыт введения препаратов бактериофагов внутривенно.

Есть и другие лекарственные формы, включая таблетки, мази, гели, суппозитории (свечи), суспензии, спреи, аэрозоли, губки.
Такое огромное количество показаний, способов введения и лекарственных форм стало возможно благодаря тому, что фаги совершенно не взаимодействуют с организмом человека. Они просто убивают опасные бактерии, а потом покидают тело. Некоторые бактериофаги становятся нашими постоянными сожителями еще с самого рождения. Они живут на коже, в кишечнике, дыхательных путях, органах мочеполовой системы, даже в крови и спинномозговой жидкости. Исследования показали, что бактериофаги из кишечника легко проникают через клетки слизистой оболочки прямо в кровеносные сосуды. Ученые пока не могут точно сказать, что «пожиратели бактерий» делают в кровотоке человека – возможно, помогают бороться с инфекциями. Так или иначе, это лишний раз доказывает, что для нас фаги совершенно безобидны.
Как подобрать правильные препараты для фаготерапии?
По своему отношению к микроорганизмам бактериофаги делятся на три группы:
- моновалентные – атакуют только бактерии определенного вида;
- поливалентные – способны поражать несколько родственных видов бактерий;
- типовые – самые привередливые, нападают лишь на бактерии определенного штамма (можно сказать, «породы») в пределах одного вида.
Препараты могут содержать только один вид бактериофагов или «коктейли» из нескольких видов. Так или иначе, чтобы лечение прошло эффективно, нужно подобрать фаг, к которому бактерии чувствительны. Для этого предварительно проводят пробы.
Для анализа пациент должен сдать какой-либо материал, в зависимости от характера инфекции: кровь, мочу, слюну, соскобы, мокроту, кал. Этот материал высевают на питательную среду, ждут, когда вырастет колония бактерий, а затем добавляют к ней растворы разных бактериофагов. Когда попадается нужный препарат, на колонии появляются полупрозрачные бляшки.
Как фаги помогают бороться с бактериальными инфекциями?
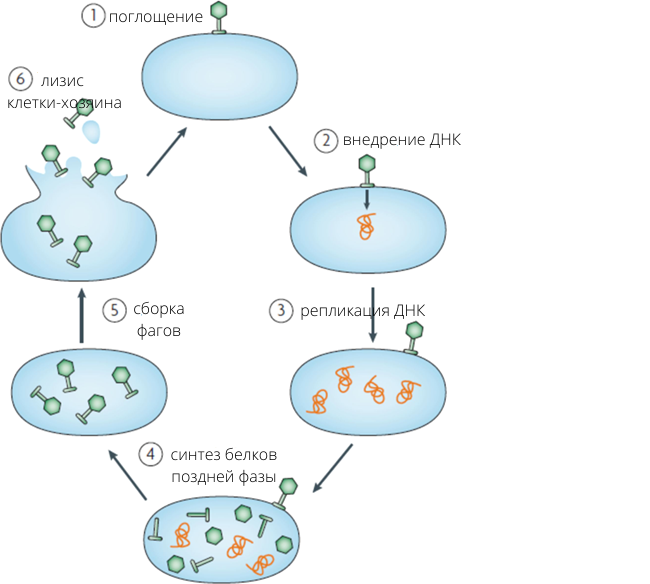
Выше мы говорили о двух группах фагов: вирулентных и умеренных. Для фаговой терапии применяются только вирулентные – те, которые убивают бактерий. Разберем подробнее механизм их действия:
- Фаг случайно натыкается своим хвостом на бактерию и прикрепляется к ее стенке с помощью специальных рецептор-связывающих белков – адгезинов.
- Происходит внедрение ДНК фага в клетку и ее встраивание в бактериальную хромосому.
- Вирусная ДНК прежде всего запускает синтез белков ранней фазы: они буквально рушат собственный обмен веществ бактерии и подавляют ее системы противофаговой защиты.
- Далее синтезируется множество копий фаговой ДНК.
- Когда накопилось достаточное количество ДНК, запускается синтез белков поздней фазы. Из них собираются новые вирусные частицы.
- Выделяется фермент эндолизин, который разрушает стенку бактериальной клетки. Наружу выходит новое поколение фагов, обычно 100–300 частиц.
Бактериофаги vs антибиотики: преимущества «пожирателей бактерий»
| Бактериофаги | Антибиотики |
| Вирулентные фаги бактерицидны, то есть они уничтожают бактерии, против которых направлены. После гибели бактериальной клетки из нее выходит новая порция фагов, готовых продолжать борьбу с инфекцией. | Антибиотики тоже могут уничтожать бактерии, но чаще всего они просто подавляют их размножение. |
| Как правило, каждый вид фагов атакует только бактерии определенного вида. Поэтому перед началом лечения нужно проводить специальные анализы и определять чувствительность микроорганизмов. Но «коктейли» из разных фагов допустимо назначать и эмпирически, без специальных анализов. | Антибиотики тоже действуют против определенных групп бактерий (но не настолько специфично). Кроме того, бактерии могут вырабатывать резистентность (устойчивость) даже к тем препаратам, к которым изначально были чувствительны, и это нужно учитывать. Можно проводить эмпирическую антибиотикотерапию препаратами широкого спектра действия. |
| Фаги действуют прицельно на «свои» бактерии, размножаются только в них. Когда все соответствующие бактерии погибают, фаги просто выводятся из организма человека, никак с ним не взаимодействуя. | Антибиотики не накапливаются в каком-то определенном месте в организме. Перед тем как покинуть организм, они перерабатываются, например, печенью. |
| Фаги – уникальное лекарство, которое само себе воспроизводит. Они размножаются в чувствительных бактериях, и со временем их становится только больше. | Антибиотики нужно вводить в организм регулярно, по времени, потому что они постоянно метаболизируются и выводятся. |
| Бактериофаги не атакуют нормальную микрофлору, они убивают только определенный вид бактерий. | Антибиотики действуют сразу против большой группы микроорганизмов. Поэтому они убивают в том числе полезные бактерии и могут вызывать дисбактериоз. |
| За счет того, что фаги атакуют только один вид бактерий, бактерии других видов не испытывают на себе их влияние и не могут выработать устойчивость. | Антибиотики действуют на многие бактерии, и многие могут к ним приспособиться, стать устойчивыми. |
| Фаги никоим образом не взаимодействуют с организмом человека. Они не поражают человеческие клетки, не включаются в обмен веществ. Мало того, организм человека постоянно контактирует с фагами – они окружают нас повсюду. Поэтому препараты для бактериофаготерапии не вызывают побочных эффектов, и это подтверждено научными исследованиями. | Антибактериальные препараты способны вызывать различные побочные эффекты, включая дисбактериоз, аллергические реакции, кишечные расстройства, грибковые инфекции. |
| Вывести новые бактериофаги, которые будут действовать на устойчивые бактерии, можно буквально за несколько недель. Достаточно найти новые эффективные фаги – а они в окружающей среде буквально повсюду – и пропустить материал (например, воду, почву или фекалии) через специальный фильтр. | Разработка новых антибиотиков занимает годы, и это намного более сложный процесс. |
| Если пациент страдает аллергией на другие лекарства – чаще всего у него можно безопасно применять фаготерапию. | Если у человека есть аллергия на антибиотик – подобрать для него другой антибактериальный препарат зачастую весьма проблематично. |
Почему в настоящее время растет интерес к фаготерапии?
Еще Александр Флеминг предупреждал, что антибиотики нельзя использовать бесконтрольно, иначе микроорганизмы приобретут к ним устойчивость. Но человечество не послушало ученого. Антибактериальные препараты до сих пор можно купить без рецепта и применять на свое усмотрение. Врачи тоже зачастую назначают их необоснованно. Антибиотики широко используют в ветеринарии, добавляют в средства гигиены. Это ускоряет эволюцию бактерий.
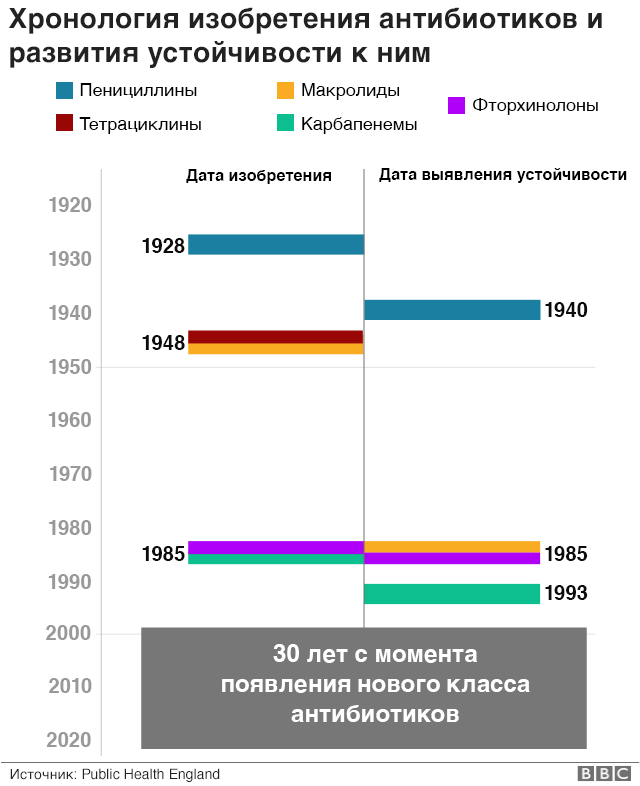
Яркий пример – золотистый стафилококк. Еще к середине 1940-х годов эта бактерия стала устойчивой к пенициллину, и с тех пор началась «гонка вооружений». Ученые создавали новые антибиотики, какое-то время они хорошо работали, а потом появлялись устойчивые микроорганизмы.
Кошмар современных врачей – метициллин-резистентные стафилококки, сокращенно MRSA. Именно их в СМИ часто называют «супербактериями». Против них уже не помогают ни пенициллины, ни цефалоспорины, ни более современные карбапенемы. Об этих микроорганизмах начали широко рассказывать относительно недавно, но на самом деле они появились еще в 1960-х годах. Против них остался единственный более-менее эффективный антибиотик – ванкомицин.
Не лучше обстоят дела и со многими другими инфекциями. Эксперты ВОЗ сообщают, что всё сложнее (а иногда и вовсе невозможно) становится лечить вызванные устойчивыми к антибиотикам бактериями пневмонии, туберкулез, пищевые инфекции, гонорею, сепсис. По данным ученых из США, в этой стране резистентными бактериями ежегодно заражается около двух миллионов людей, и 23 тысячи из них погибают.
При этом разработка новых антибактериальных препаратов становится всё сложнее, дольше и дороже. Ни одна фармкомпания не хочет этим заниматься: производители не видят смысла тратить огромные ресурсы на создание нового лекарства, которое спустя несколько лет всё равно перестанет действовать и не будет хорошо продаваться. На этом фоне стали возникать пессимистичные и даже панические настроения: некоторые ученые и врачи поговаривают, что из-за снижения эффективности антибиотиков мы можем откатиться в мрачное Средневековье, когда эпидемии уносили множество жизней.
Однако ученые не сдаются. Они активно ищут альтернативы антибиотиками, и одной из таких альтернатив может стать бактериофаготерапия. Плюс фагов в том, что они хорошо работают против бактерий, на которые перестали действовать антибиотики.
Интересный факт. На самом деле бактерии вырабатывают устойчивость к фагам намного быстрее, чем к антибиотикам. Но это не проблема. Во-первых, зачастую можно быстро подобрать новые эффективные фаги. Ведь вирусы тоже быстро мутируют и эволюционируют. Они участвуют в «гонке вооружений» с бактериями уже миллиарды лет и хорошо поднаторели в этом деле. Во-вторых, устойчивость к фагам – не бесплатное удовольствие. Такие бактерии становятся менее опасными для человека и менее устойчивыми к антибиотикам.
Какие проблемы возникают при использовании бактериофаготерапии?
В мире нет ничего идеального, и бактериофаги не исключение. Фаготерапия не панацея, с ее применением тоже возникают определенные проблемы:
- Узкий круг хозяев. Фаги уничтожают только определенные виды бактерий, и их нельзя подобрать «на глаз», как это зачастую получается с антибиотиками. Перед тем как начинать фаговую терапию, нужно провести анализы и проверить чувствительность микроорганизмов. Это требует определенного времени, а еще за анализы придется дополнительно платить. К тому же заранее неизвестно, насколько быстро получится найти подходящие фаги, и получится ли вообще.
- Бактерии могут вырабатывать устойчивость к бактериофагам. Ведь их эволюция тоже никогда не останавливалась, и они обзавелись массой способов защиты. Самый известный – бактериальная «иммунная система» – CRISPR-Cas. В ДНК бактерий есть вставки с копиями генетического материала фагов. Они с помощью специальной РНК могут распознавать вирусные гены, в итоге активируются специальные ферменты, которые разрушают «чужой» генетический материал. Хотя в теории можно быстро вывести новый эффективный вид фагов, на практике появляются некоторые трудности.
- Фаги могут усиливать устойчивость бактерий к антибиотикам. Умеренные бактериофаги могут встраивать в ДНК бактерий гены, в том числе связанные с антибиотикорезистентностью.
- Иммунная система человека сопротивляется лечению. Хотя фаги и безобидны для организма, они воспринимаются иммунитетом как чужеродные частицы. Иммунная система не понимает, что это ее помощники, и уничтожает их. Из-за этого активность фаготерапии снижается.
- Фаги действуют медленнее, чем антибиотики. Во многом именно из-за этого в прошлом веке антибактериальные препараты сильно потеснили бактериофаготерапию.
Как видно, проблем немало, и они накладывают определенные ограничения. Тем не менее фаговая терапия продолжает развиваться. Например, во время пандемии COVID-19 департамент США по контролю качества лекарственных препаратов и пищевых продуктов одобрил применение фагов при тяжелом течении инфекции, осложненной, бактериальной пневмонией. У бактериофаготерапии есть потенциал и, вероятно, немалый. Ученым и врачам еще предстоит его раскрыть.
Список литературы и библиографических ссылок:
- bbc.com – Жизнь до антибиотиков и возможная жизнь после антибиотиков
- frontiersin.org – Преимущества и недостатки бактериофагов для лечения бактериальных инфекций
- who.int – Устойчивость к антибиотикам
- ema.europa.eu – Исторический обзор развития бактерофаготерапии
- frontiersin.org – Применение бактериофагов в лечении локализованных инфекций у человека
- ncbi.nlm.nih.gov – Бактериофаготерапия